Kaynama Noktası Bulma
Arşiv Bağlantısı
Arşiv Bağlantısı
Daha Fazla Cevap Göster
Cevap Ver
Evrim Ağacı Soru & Cevap Platformu, Türkiye'deki bilimseverler tarafından kolektif ve öz denetime dayalı bir şekilde sürdürülen, özgür bir ortamdır. Evrim Ağacı tarafından yayınlanan makalelerin aksine, bu platforma girilen soru ve cevapların içeriği veya gerçek/doğru olup olmadıkları Evrim Ağacı yönetimi tarafından denetlenmemektedir. Evrim Ağacı, bu platformda yayınlanan cevapları herhangi bir şekilde desteklememekte veya doğruluğunu garanti etmemektedir. Doğru olmadığını düşündüğünüz cevapları, size sunulan denetim araçlarıyla işaretleyebilir, daha doğru olan cevapları kaynaklarıyla girebilir ve oylama araçlarıyla platformun daha güvenilir bir ortama evrimleşmesine katkı sağlayabilirsiniz.
Sorulara DönEvrim Ağacı'na Destek Ol
Evrim Ağacı'nın %100 okur destekli bir bilim platformu olduğunu biliyor muydunuz? Evrim Ağacı'nın maddi destekçileri arasına katılarak Türkiye'de bilimin yayılmasına güç katmak için hemen buraya tıklayın.
Popüler Yazılar
EA Akademi
Evrim Ağacı Akademi (ya da kısaca EA Akademi), 2010 yılından beri ürettiğimiz makalelerden oluşan ve kendi kendinizi bilimin çeşitli dallarında eğitebileceğiniz bir çevirim içi eğitim girişimi! Evrim Ağacı Akademi'yi buraya tıklayarak görebilirsiniz. Daha fazla bilgi için buraya tıklayın.
Etkinlik & İlan
Bilim ile ilgili bir etkinlik mi düzenliyorsunuz? Yoksa bilim insanlarını veya bilimseverleri ilgilendiren bir iş, staj, çalıştay, makale çağrısı vb. bir duyurunuz mu var? Etkinlik & İlan Platformumuzda paylaşın, milyonlarca bilimsevere ulaşsın.
Podcast
Evrim Ağacı'nın birçok içeriğinin profesyonel ses sanatçıları tarafından seslendirildiğini biliyor muydunuz? Bunların hepsini Podcast Platformumuzda dinleyebilirsiniz. Ayrıca Spotify, iTunes, Google Podcast ve YouTube bağlantılarını da bir arada bulabilirsiniz.
Aklımdan Geçen
Aklımdan Geçen
Fark Ettim ki...
Bugün Öğrendim ki...
İşe Yarar İpucu
Bilim Haberleri
Hikaye Fikri
Video Konu Önerisi
Kafana takılan neler var?
Bilim, hep birlikteyken güzel. 2023'te Evrim Ağacı'na destek olun!
Bu yıl sayfamızda gezdiniz.
2010 yılından beri Türkiye'de bilim iletişimini geliştirmek adına durmaksızın ter döküyoruz ve sizin gibi bilimseverlerin destekleri sayesinde Türkiye'nin en çok ziyaret edilen, en güvenilir, en büyük bilim arşivini yaratmaya devam ediyoruz. Sitemizde reklamlar görüyor olsanız da bunların bize getirisi önemsenmeyecek kadar az. Bizi ayakta tutan, Türkiye'deki bilimseverlerin gönüllü destekleri. Eğer 2023 yılında da Türkiye'de bilimi yeşertme çabalarımıza katkı sağlamak isterseniz, maddi destekçilerimiz arasına katılabilirsiniz. Hatta bu sayede sitemizi ve mobil uygulamamızı tamamen reklamsız bir şekilde kullanmanız mümkün olacak. Tek seferlik destek olun veya daha iyisi, aylık destekçilerimiz arasına şimdi katılın.

Kreosus (₺)YoutubePatreonDiğer Yöntemler
Evrim Ağacı
Türkiye'deki bilimseverlerin buluşma noktasına hoşgeldiniz!
Şifrenizi mi unuttunuz? Lütfen e-posta adresinizi giriniz. E-posta adresinize şifrenizi sıfırlamak için bir bağlantı gönderilecektir.
Geri dön
Eğer aktivasyon kodunu almadıysanız lütfen e-posta adresinizi giriniz. Üyeliğinizi aktive etmek için e-posta adresinize bir bağlantı gönderilecektir.
Geri dön
“ Sadece eğitimli olanlar özgürdür.”
Epictetus
Bilim İçin 30 Saniyeniz Var mı?
Evrim Ağacı, tamamen okur ve izleyen desteğiyle sürdürülen, bağımsız bir bilim oluşumu. Ücretsiz bir Evrim Ağacı üyeliği oluşturmanın çok sayıda avantajından biri, sitedeki reklamları %50 oranında azaltmak (destekçilerimiz arasına katılarak reklamların %100'ünü kapatabilirsiniz). Evrim Ağacı'nda geçirdiğiniz zamanı zenginleştirmek için, sadece 30 saniyenizi ayırarak üye olun (üyeyseniz, giriş yapmanızı tavsiye ederiz).
Üye Ol
Giriş Yap
Üyeliğin AvantajlarıKaynama noktası: sıvının buhar basıncının dış basınca eşit olduğu noktadır.
kaynama olması için dıştan yapılan basıncın içteki basınca eşit olması gerekiyor ki kaynama gerçekleşsin. Bu yüzden aynı ortamda kaynayan bütün sıvıların kaynarkenki buhar basınçları birbirine eşittir. Çünkü aynı ortam olduğundan dolayı dış basıncımız sabittir buna bağlı olarak da buhar basıçları eşit olur tabi kaynama noktasında.
kaynama noktası 3 faktöre baglıdır;
Sıvının cinsi
Dış basınç
Safsızlık
Kaynama noktası yükselmesi
Çözeltinin kaynama noktası saf çözücününkinden daha yüksektir. Buna örnek olarak tuzlu su ve saf suyu verebiliriz.Tuzlu suyun kaynama noktası saf sudakinden daha fazladır.Tuz ekleyerek kaynama noktası yükseltmiş oluruz
Tuzlu su kaynarken ne olur?

tuzlu suyu kaynama noktası 100 derece den büyüktür. Kaynama başladıktan sonra su molekülleri yüzey alanından başlayarak buharlaşacağı için su miktarı azalır ve çözeltide ki tuz oranı artmış olur.Bu oran da suyun azalmasından dolayı artar. Yoksa tuz da bir degişiklik olmaz.Tuz oranı suyun azalmasından dolayı sürekli artacağı için de kaynama sırasında sıcaklık sabit kalmaz artar. Bu artış çözelti doygunluğa ulaşana kadar devam eder.Doygunluğa ulaşınca sıcaklık sabitlenir çünkü doygunlukta maksimum madde miktarını çözmüştür.Daha çözemeyeceği için sıcaklık sabitlenir.
Kaynama ve buharlaşma arasındaki fark nedir?
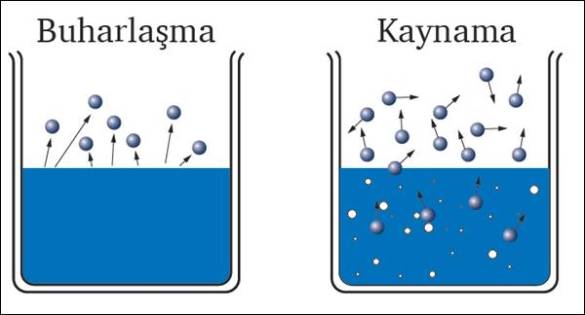
Buharlaşma sıvının gaz hale geçmesidir.———Kaynama sıvının içindeki buhar basıncının dış basınça eşit olduğu durumda kabarcıklar çıkararak çok hızlı şekilde buharlaşmaya baslaması durumudur.
Buharlaşma her sıcaklıkta olur—–Kaynama sadece tek bir sıcaklıkta olur.
2M CaCI2 ve 2M KI aynı koşullardadır. bunların kaynama noktalarını karşılaştırın.
Derişimlerii aynı diye hemen kaynma noktaları aynı demek yanlış olur. Bu bilindik yapılan bir hatadır. Biz burda maddenin kendi derişimini değil de suya verdiği taneciklerin derişimine bakarak karşılaştırma yapmalıyız.
CaCI2(K)——-Ca+2(suda)+2CI-(suda)
burda girenlerdeki caCI2 2M iken ürünlerdeki Ca 2M CI ise 4M dir. toplamda 6M olur
KI——-K+(suda) +I-(suda)
burda girenler 2M iken ürünlerde K 2M I 2M toplamda 4M olur
1.de daha fazla molar tanecik suya verdiği için kaynama noktası 1>2 dir
0.4M C6H12O6 ve 0.1M Al(NO3)3 kaynama noktalarını karşılaştırın
a) 0.4 M tanecik suya verir. Çünkü şeker moleküler çözünür.
b) 0.1 M +0.3M =0.4 M tanecik suya verir
o zaman suya verigi tanecik sayıları eşit oldugu için 1=2
BeğenYükleniyor...
Bir maddenin kaynama noktası, bir maddenin fiziksel durumunu sıvıdan buhara değiştirdiği sıcaklık olarak tanımlanabilir. Etrafımızdaki maddelerden, halihazırda gaz halinde olanların çok düşük kaynama noktalarına sahip olduğunu ve bir maddenin sıvı veya katı olması durumunda kaynama noktalarının arttığını anlamamız gerekir.
Bir maddenin sıvı halindeyken moleküllerin onları bir arada tutan etkileşimlere sahip olduğunu biliyoruz. Sıcaklığı arttırdıkça, moleküllerin kinetik enerjisine dönüştürülen ısı enerjisi sağlıyoruz. Bu, kabarcık oluşumunu gözlemlediğimiz kaynama ile gösterilir. Kinetik enerji, çözeltideki moleküller arasındaki etkileşimin üstesinden gelmek için yeterliyse, bu moleküller çözeltiden kaçabilir ve gaz fazına geçebilir. Bu zamandaki sıcaklık kaynama noktası olarak adlandırılır ve bu zamanda çevreleyenin basıncı, gaz halindeki maddenin buhar basıncına eşittir.
Kaynama noktası, bir maddenin sahip olduğu moleküller arası etkileşimlerin türüne göre değişir. Etkileşimler, örneğin Hidrojen bağları, iyonik bağlar daha yüksek, kaynama noktası daha güçlüdür. Etkileşim zayıfsa, kaynama noktası düşüktür. Vanderwaal'in kuvvetleri.
Kaynama noktasının basıncın bir fonksiyonu olduğu gözlenmiştir (basınçla değişir). Normal kaynama noktası, bir maddenin atmosferik basınç altında (genellikle 1 atm) fiziksel durumunu sıvıdan buhara değiştirdiği sıcaklıktır.
Bir maddenin kaynama noktasını bulmak için birçok yol vardır.

Isı, sıcaklığa göre bu şekilde değişir.
a. Katı artan sıcaklık
b. Katıdan sıvıya faz geçişi (sıcaklığın sabit olduğuna dikkat edin = Erime noktası)
c. Sıvı artan sıcaklık
d. Sıvıdan buhar fazına geçiş (sıcaklığın sabit olduğuna dikkat edin = Kaynama noktası)
e. Buhar artan sıcaklık
Grafikten, sıvıdan buhara faz geçişini tanımlayabilir ve karşılık gelen sıcaklığı kaynama noktası olarak alabiliriz.
Her madde için, buhar basıncını birkaç sıcaklıkta bulabilir ve bir grafik çizebiliriz. Buhar basınçları deneysel olarak elde edilebilir.

Bununla, a, b veya c maddesinin kaynama noktalarını herhangi bir basınçta bulabiliriz. Çünkü,
Kaynama noktası = Buhar basıncının yapıldığı sıcaklık = Çevrenin dış basıncı.
Yatay kesikli çizgi, maddenin kaynama noktalarının atmosferik sıcaklıkta nasıl değiştiğini göstermektedir. Değişime bakıldığında, Moleküler etkileşimlerin Gücünü söyleyebiliriz: a <b <c
Basıncı düşürmenin, maddelerin düşük sıcaklıklarda kaynamakta olduğunu da görebiliyoruz. Örneğin, su alırsak, 101.3 kPa'da (1 atm) 100⁰C'de, 50kPa'da ise 78⁰C'de kaynar.
Entalpi ve Entropinin Buharlaşma Değişimi Biliniyorsa Kaynama Noktası Bulma
50,777 görüntülenme
Cevap Ver
Zayıf etkileşimlerde ilk olarak hidrojen bağına bakılır ,Hidrojen bağı içeren birleşikler genellikle diğer birleşiklere göre daha yüksek sıcaklıkta kaynarlar.
Daha sonra Dipol dipol etkileşim var mı yok mu ona bakarız,karşılaştırmak için ,örneğin apolar bir moleküldeki etkileşim london kuvvetleri vardır ,polar moleküllerde de hidrojen bağı yada dipol dipol etkileşim vardır ,bu iki birleşiği kıyaslarken genelde polar molekülün ki daha yüksek sıcaklıkta kaynar deriz.
Eğer karşılaştıracağımız moleküllerde ,hepsinde aynı etkileşim varsa en son london kuvvetlerine bakarız ,london kuvvetlerinde de molekül ağırlığı arttıkça london etkileşimleri de artış gösterir.
13,536 görüntülenme